Introducción
La biomicroscopía, biomicrografía con lámpara de hendidura o lámpara de hendidura, es un examen que todo profesional del área de oftalmología debe manejar, en mayor caso los médico oftalmólogos, donde su función principal es observar el globo ocular, de manera general o específico, mediante diferentes aumentos y técnicas de iluminación.
Historia
Una de las primeras personas en aplicar la microscopía en el ojo, fue Purkinje, que en el año 1820 aproximadamente, estudiaba el iris con un microscopia ajustable al iluminar el campo de visión.
Años más tarde, nació la lámpara de hendidura monocular cuando Luis de Wecker combinó un ocular, un objetivo y un lente condensadora ajustable dentro de un tubo. Luego fue mejorada por Siegfried Czapski, quién agrego la binocularidad a este microscopio. Pero ninguna de estas unidades creados y modificados por estos individuos, tenía la iluminación suficiente para poder observar con mayor detalle el globo ocular.
En 1851, Hermann Von Helmholtz (1821 - 1894) construyó un pequeño aparato formado por tres cirstales que actuaban como espejos de reflexión parcial. Su funcionamiento era casi tan simple como rudimentario, pues la luz se reflejaba en los cristales y se dirigía al interior del ojo del paciente y el examinador debía interponer distintas lentes entre el instrumento y el ojo de su paciente para lograr un mejor enfoque de la imagen observada. Pese a sus limitaciones, el invento revolucionó el campo de la oftalmología, pues por primera vez hizo posible examinar el fondo de ojo del ser humano, donde este instrumento se llamó "Oftalmoscopio" y desde entonces hasta el 1880 se realizan diferentes diseños mejorando la calidad de imagen y eliminado los reflejos producidos al realizar la observación.
En el año 1855, Richard Liebreich (1830 - 1917), discípulo de Helmholtz, Donders y Von Graefe, tiene un interés en los cambios patológicos del ojo, iniciando ensayos para un nuevo instrumento combinando un sistema de observación con una fuente de iluminación que hicieran foco sobre el punto de examen.
Allvar Gullstrand, un famoso médico oftalmólogo y ganador del premio Nobel en el año 1911, desarrollo la primera lámpara de hendidura que verdaremente tenía la iluminación acorde para poder examinar el ojo de manera clínica. Los instrumentos actuales no difieren mucho de los primeros diseños, aunque presentan una considerable mejora que los hacen más prácticos y manejables a la vez que permiten una mejor visualización de los medios oculares.
Destaca la variedad de nombres que recibe este insturmento: Biomicroscopio ocular, microscopio de lámpara de hendidura, lámpara de Gullstrand (Fig. 1) y lámpada de hendidura.
 |
| Fig. 1 Gran oftalmoscopio de Gullstrand |
Descripción del Biomicroscopio
El biomicroscpio puede dividirse en 3 componentes:
1. El brazo de iluminación (Provee luz controlada).
2. El brazo de observación (Conteniendo microscopios).
3. Anexos (Por ejemplo: Mentonera y elementos que permiten ajustar al paciente al equipo).
Brazo de iluminación
El brazo de iluminción, como el nombre lo indica, es lo que proporciona la iluminación al realizar el examen en el sector a evaluar deseada, en el ojo. Todas las lámparas de hendidura suelen incluir un sistema de iluminación tipo Köhler (Fig. 2), es decir, idéntico que un proyector de 35 mm, sólo que con una apertura variable y una focal mucho más corte.
 |
Fig. 2 Sistema de iluminación de Köhler |
La fuente de iluminación consta de un bulbo de tungsteno, pero en la actualidad se están reemplazando por iluminación LED, para mayor producción de calor. Detrás de la iluminación LED, se coloca un espejo reflectante, cuyo radio de curvatura coincide con el sistema de iluminación LED, incrementando en gran medida la cantidad de luz que ingresa a la lente condensadora (Fig. 3).
 |
| Fig. 3 Comparación esquemática entre un sistema sin espejo (A la izquierda) y otro con espejo (A la derecha) |
La luz que sale del bulbo es recogida por las lentes condensadoras, creando una imagen sobre la lente de proyección o muy cerca de ella, con esto logra que el haz saliente sea extremadamente homógeneo. un poco más adelante de las lentes condensadoras se ubica la hendidura. Los rayos que atraviesan la hendidura formará una imagen de la misma, gracias a la lente de proyección, en el ojo del paciente.
Es importante corregir debidamente la aberración cromática en las condensadoras, es por ello que suele utilizarse sistemas de dos o más lentes con este fin. La lente de proyección puede inducir aberraciones acromáticas en el sistema, por lo que ésta suele tener poco diámetro, resultando en una mejor caldiad de la imagen de la hendidura. El escaso tamaño de la lente de proyección también incide en la profundidad de foco de la hendidura, dando un mejor segmento óptico del tejido observado.
En el biomicroscopio el sistema de iluminación se encuentr de forma vertical, por una cuestión de espacio. Es por esto que se coloca un especjo a 45° que desvía los rayos del sistema hacia el ojo del paciente para proyectar en este la imagen de la hendidura. Otros instrumentos, en vez del espejo existe un prisma, que cumple la misma función.
 |
| Fig. 4 Esquematización completa del brazo de iluminación desde la proyección de luz hasta el objetivo (Ojo del paciente) |
Por delante de las lentes condensadoras, se ubica el control del ancho y alto de la hendidura como así también diversos diafragmas que pueden cambiarse para seccionar el tamaño del haz de iluminación. La hendidura también podrá rotarse y mediante el uso de una escala graduada podrá evaluarse dicha rotación (Fig. 5).
 |
| Fig. 5 Vista superior del brazo de iluminación |
 |
| Fig. 6 Vista inferior del brazo de iluminación. Lo que se destaca es el mando de selección del ancho de la hendidura |
Entre la hendidura y la lente de proyección se coloca un revolver con diversos filtros. Los filtros más comunes son: Aneritra (Libre de rojo), azul de cobalto, filtro de densidad neutra y filtor de absorción de calor. Además, algunas lámparas, también cuentan con un filtro amarillo que va colocado por delante o dentro del microscopio (En el brazo de observación).
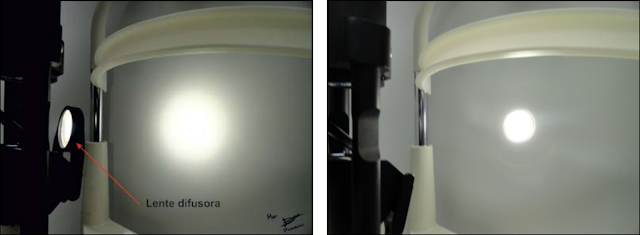 |
| Fig. 7 Se realiza diferencia al colocar el difusor (Izquierda) y el no colocarlo (Derecha) |
Por delante del espejo, por lo general, se puede encontrar una lente difusora, la cual es una lámina de vidrio de caras esmeriladas y paralelas (Fig. 7). Lo que logra este filtro difusor, es interponerse en la marcha de rayos, dispersando la luz uniformemente.
 |
| Fig. 8 Muestra el brazo de iluminación en posición normal (Derecha) y en su máxima inclinación (Izquierda). Lo que está resaltado (Rojo) es la perilla Clip - off |
El brazo de iluminación, puede inclinarse desde su base mediante una perilla "Clip off" pudiendo rotar en su eje vertical, moviendose a ambos lados, ya sea por la rotación del brazo en su conjunto, o simplemente por el giro del espejo / prisma. Logrando desplazar la hendidura a la derecha o a la izquierda, cuando se observa a través del instrumento.
Brazo de Observación
 |
| Fig. 9 Brazo de observación |
El brazo de observación contienen un microscopio binocular de distancia de trabajo larga, es decir, la distancia entre la lente objetivo y la distancia de trabajo es bastante mayor que la de un microscopio convencional. Esta cualidad permite al observador poder manipular los párpados del paciente, colocar o extraer la lente de contacto, instilar fluoresceína, extracción de cuerpo extraño, entre otras cosas. Posee un sistema de magnificación desde x6 a x40, siendo los intermedios más comunes 10x, 16x, 25x.
Esta parte, está compuesto básicamente por dos elementos ópticos: Objetivo y ocular (Fig. 10). El sistema puede ser simplificado a dos lentes positivas, donde el objetivo es de distancia focal más larga. En la actualidad, el ocular está compuesto por varias lentes para disminuir las aberraciones y en algunos casos, el objetivo también será construido por varias piezas ópticas (Doblete acromático)
 |
| Fig. 10 Esquema simplificado del sistema de observación |
La imagen entregada en el sistema de observación (Según la Fig. 10), nos entrega una imagen invertida, es por eso que la lámpara consta con un par de prismas entre el objetivo y el ocular, permitiendo una imagen derecha. En la gran mayoría de instrumentos, estos prismas pueden regularse, permitiéndonos ajustar la distancia interpupilar del examinador.
 |
| Fig. 11 Esquema de la marcha de rayos. Los prismas invierten la imagen, permitiendo que el observador obtenga una imagen derecha |
Sistema de magnificación
Esta parte nos permite magnificar las imágenes a observar de forma variable. La cual pueden aplicarse distintas modificaciones al sistema de forma tal, que se producirá un cambio en su aumento:
> Diferentes objetivos : Normalmente tiene dos diferentes lentes objetivos, la cual están dispuesto de forma tal que mediante una palanca y un sistema mecánico pueden intercambiarse, logrando tener la variación de dos aumentos.
> Diferentes oculares: Mediante el cambio de oculares, puede lograrse ampliar el rando de magnificaciones del instrumento. Este tipo de artilugio suele tenerse en instrumentos en los que se alterna dos objetivos, teniendo así la posibilidad de dos distintos aumentos. Logrando un total de 4 aumentos.
> Telescopio Littmann - Galileo : Este sistema está ubicado entre el objetivo y el ocular, permite la variación del aumento sin requerir el cambio de ninguna pieza del aparato. Está compuesto por un tambor que rota sobre su eje, conteniendo diversos telescopios de Galileo (Fig. 12) (Consta típicamente de una lente positiva como objetivo y una lente negativa como ocular. En el sistema Littmann, los telescopios son utilizados tanto del derecho del revés, permitiendo un incremento como una disminución de la imagen, logrando que por cada telescopio se obtengan dos aumentos distintos. Las lámparas cuentan con 2 telescopios, que proveen 4 aumentos distintos y una posición libre de telescopios que entregará la imagen sin alterar, brindando un total de 5 aumentos distintos (Fig. 13).
 |
| Fig. 12 Esquema de un telescopio de Galileo |
 |
| Fig. 13 Esquema del diafragma de la marcha de rayos con un sistema de Littmann - Galileo |
Sistemas de Zoom
El sistema de Zoom, provee un aumento variable que normalmente alcanza al rango desde los 7x a los 35x.
Oculares
Los oculares (Fig. 14), se encuentran de a pares en la lámparas de hendidura, deben ser regulador para compensar el defecto refractivo del examinador. La calibración se realiza con un vástago (Incluido en toda lámpara), colocándose en la bisagra entre ambos brazos (Fig. 15), luego observar el haz luminoso en dicho vástago nítido enroscando y desenroscando dichos oculares. Otra técnica para calibrar los oculares, es enfocar los párpados del paciente, utilizándolo como pantalla (Se le pide al paciente que cierre los ojos).
 |
| Fig. 14 Oculares |
 |
| Fig. 15 Posición del vástago (Resaltado en rojo) para la respectiva calibración |
El brazo de observación también podrá contener sistema divisores del haz también llamados "Beam - splitters" (Fig. 16), con el que se logra crear una separación de la imagen que podrá ser recogida por otro ocular distinto al del observador o por una cámara pudiendo así capturar imágenes
 |
| Fig. 16 Beam - Splitter |
Puede hallarse también un sistema que permite interponer en la marcha de rayo un filtro amarillo (Fig. 17), con el fin de realzar el contraste cuando se utiliza fluoresceína como tinción. Normalmente, se encuentra entre el lente objetico y el sistema de magnificación.
 |
| Fig. 17 A la derecha, tenemos un filtro amarillo, a la izquierda es colocado delante del ocular para realizar la observación (Vista del paciente) |
Anexos del Biomicroscopio
Los brazos de iluminación y observación se encuentran unidos por sus extremos sobre un pivote móvil de tal forma que puede variarse el ángulo que hay entre ellos y mediante el uso de una escala graduado, evaluarse numéricamente. Esto tiene gran utilidad al definir y realizar las ténicas de observación de este instrumento.
 |
| Fig. 18 Se observa la unión de ambos brazos y su escala graduada |
Ambos sistemas están montados sobre un carril que permite desplazar el aparato hacia atrás, adelante y a ambos lados, pudiéndose bloquear en una posición fija utilizando la traba de carril. Mediante el uso de Joystick o palanca de mando puede controlarse de forma precisa este desplazamiento pudiéndose así buscar y enfocar correctamente. Generalmente al enroscar la palanca de mando, o con algún otro mando provisto por el fabricante, un mecanismo eleva o desciende ambos brazos, permitiendo así un desplazamiento vertical del campo observado.
Con un reóstato, se controlará la intensidad de luz que sal del bulbo, variando el voltaje del mismo. Este control de iluminación, al igual que el joystick, suele encontrarse en la base del instrumento.
 |
| Fig. 19 Base de una lámpara de hendidura |
Para lo que es el paciente, el biomicroscopio cuenta con una frentonera, dónde el paciente apoyará su frente, así como también una mentonera para el apoyo del mentón, todo esto para mantener fija la cabeza del paciente. Con el control de la altura de la mentonera, se debe ubicar el canto externo del ojo del paciente a una marca, generalmente ubicada en los postes que sostienen la frentonera (Fig. 20).
 |
| Fig. 20 Vista frontal de un biomicroscopio |
Sobre la frentonera, suele ubicarse el objeto de fijación que sirve para que el paciente mantenga la vista fija durante el examen. Suele existir de diversa complejidad, yendo desde una simple luz puntual, hasta sistemas de lentes que proyectan un testigo. Es conveniente presentar el testigo solamente al ojo no examinado para no bloquear el campo de observación del biomicroscopio.
La lámpara de hendidura suele descansar en una mesa de soporte que cuenta con un sistema mecánico de control de altura. Es importante acomodar la mesa a la altura del paciente para con máximo confort, luego acomodar la mentonera, según su marca de referencia.
 |
| Fig. 22 Parte inferior de la mesa de un biomicroscopio |
Técnicas de iluminación
El biomicroscopio, nos ofrece una visión detallad, no invasiva y estereoscópica del globo ocular. Para ver los diferentes tejidos oculares transparentes o semitransparentes, como es la córnea y el cristalino, se permite el empleo de difernetes técnicas de iluminación y observación. La cual se diferencian, en la cantidad de iluminación, el ancho y el alto del haz de luz, el ángulo de iluminación, la relación entre el lugar de observación e iluminación y/o el empleo de filtros u accesorios.
Dentro de las cuales, las técnicas de iluminación actuales, son:
1. Iluminación difusa.
2. Iluminación focal directa:
- Paralelepípedo de Vogt.
- Sección óptica.
- Haz cónico.
- Reflexión especular.
- Iluminación tangencial.
3. Iluminación focal indirecta.
4. Iluminación filtrada.
5. Técnica de Van Kerick.
Iluminación Difusa
El objetivo principal de esta técnica es realizar una revisisón general de las estructuras oculares de manera macroscópica (Fig. 23). La cual consiste en iluminar la porción anterior del globo ocular con un amplio haz de luz circular dirigido de forma oblicua. Para realizar dicho procedimiento se emplea un vidrio esmerilado llamado Difusor que se coloca delante del haz de luz de la lámpara para obtener un haz de luz difuso, amplio y homogéneo, iluminando la superficie ocular de forma pareja, permitiendonos realizar una visualización macroscópica de la salud visual del segmento anterior de nuestro paciente.
Sin embargo, algunos modelos de biomicroscopios, no cuentan con un difusor, por lo que se sugiere dos formas de hacer algo muy parecido.
1. Colocar un haz de luz circular, con baja intensidad de iluminación, para evitar molestias al paciente, pero requiere un amplio recorrido para explorar todas las estructuras.
2. En las cajas de lentes (Si es que hay una mano en la consulta), se puede extraer una lente que también cumple la función de un difusor, se coloca en el brazo de iluminación y se puede realizar la exploración de igual forma.
 |
| Fig. 23 Imagen de las estructuras oculares, mediante la técnica de iluminación difusa. A) Con difusor; B) Sin difusor, pero con un haz de luz circular y un aumento de 10x |
Esta técnica, se emplea un haz de luz amplio, el ángulo del brazo de iluminación no es crítico y puede variar entre 10° y 60°, aunque usualmente se deja en un ángulo de 45°, para evitar obstruir el campo de visión y además también se pueden aplicar diferentes aumentos, para ver mejor y en detalle las diferentes estructuras oculares (Fig. 24).
 |
| Fig. 24 Esquema de la ténica de iluminación difusa |
Lo que nos permite ver en la clínica, esta técnica, son las siguientes estructuras (Fig. 25): Pestañas, párpados, puntos lagrimales, orificios de las glándulas de meibomio, repliegue semilunar, carúncula, conjuntiva, vasos esclerales, córnea, iris, pupila, película lagrimal y vasos limbares.
 |
| Fig. 25 Análisis de diferentes estructuras con la iluminación difusa |
La eversión de la conjuntiva tarsal superior (Fig. 26), es un procedimiento indoloro. La técnica, es usar los dedos o cotones (Esté ultimo, es mucho más práctico). ¿Cómo se realiza? Se le pide al paciente que "MIre hacia abajo", pero NO la cabeza, solo la mirada, luego tomar el borde del margen palpebral, traccionar hacia afuera, hacia abajo y luego dar vuelta. El paciente, debe estar apoyado en todo momento en el equipo.
 |
| Fig. 26 Técnica de eversión de la conjuntiva tarsal superior |
La eversión de la conjuntiva tarsal inferior (Fig. 27), es mucho más fácil que la eversión del párpado superior, solo el paciente tiene que mirar hacia arriba y luego dar vuelta.
 |
| Fig. 27 Técnica de eversión de la conjuntiva tarsal inferior (Paciente con conjuntivitis) |
 |
| Fig. 28 Signos observados con la iluminación difusa en las diferentes estructuras oculares |
Esta técnica, también nos permite observar el lente de contacto, evaluando sus movimientos, la ubicación, la humectabilidad, la estabilidad de la película lagrimal pre-lente, la presencia de depósitos, rayas o roturas del lente
Procedimiento de la iluminación difusa
1. Bajar iluminación ambiente.
2. Ajustar oculares, empleando el calibre adecuado.
3. Acomodar la altura de la mesa de acuerdo a la contextura y la altura del paciente.
4. Instruir al paciente, para que se siente correctamente, apoyando la frente y el mentón en el equipo, indicandole además que observe el punto de fijación o mirando derecho al frente.
5. Ajustar la mentonera, para que el canto externo del paciente coincida con la marca de los soportes laterales de la frentonera del equipo.
6. Desbloquear y encender el equipo.
7. Controlar la intensidad de la luz, que se encuentre baja.
8. Comenzar la exploración con el OD del paciente.
9. Colocar el brazo de iluminación del lado temporal del ojo del paciente con un ángulo entre 10° y 60°.
10. Colocar el difusor y luego abrir la hendidra al máximo con un diámetro de 10 mm.
11. Colocar un aumento bajo x6 o x10.
12. Desplazar el instrumento hacia delante o atrás, empleando el Joystick hasta enfocar, y acomodar la altura de la lámpara rotando el mismo instrumento, hasta lograr situar la estructura ocular que se va a observar en el centro del campo de visión.
13. Evaluar las diferencias estructuras según Fig. 28 y hacer lo mismo, pero con el OI.
Iluminación focal directa
Esta técnica consiste en concentrar un haz de luz cónico, utilizando una lente biconvexa sobre el área a estudiar del ojo del paciente.
La pregunta es ¿Por qué es directa? Debido a qué el punto focal del sistema de iluminación coincide exactamente con el punto focal del sistema de observación. Es decir, que el punto o la zona iluminada de la estructura ocular coinciden con el punto o la zona observada.
Se debe tener en cuenta que tanto la córnea como el cristalino son tejidos semitransparentes. Ambas estructuras presentan una heterogeneidad íoptica en su interior ya que poseen diferentes zonas de discontinuidad óptica (O índice de refracción). Como resultado, cuando se emplea este tipo de iluminación focal directa para observar esos tejidos semitransparentes, se produce una dispersión del haz de luz en cada zona de discontinuidad óptica de diho tejido. Esta dispersión se la conoce con el nombre de opalescencia, y se observa con un aspecto brillante o reluciente de color blanco o grisáceo (Fig. 30).
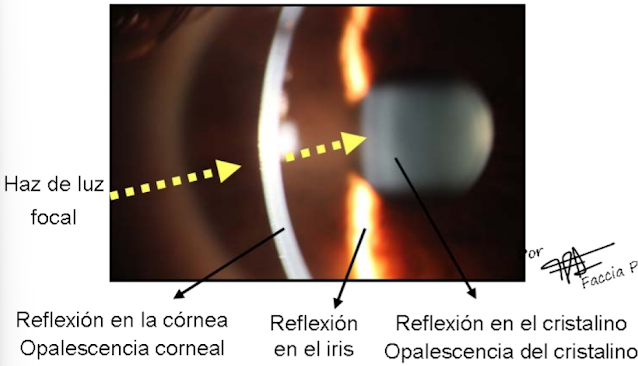 |
| Fig. 30 Diferentes tipos de reflexiones de un haz de luz focal dirigido hacia el ojo y observación de la opalescencia que se forma en los medios semitransparentes (Córnea y cristalino) |
La intensidad de ese brillo depende de la densidad del medio, cuanto mayor sea ésta más brillante y blanco se observará el tejido o zona iluminada. De esta forma analizando la opalescencia de las diferentes estructuras es posible detectar condiciones anormales o patológicas en los tejidos ocular.
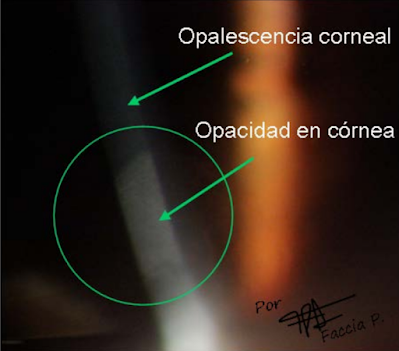 |
| Fig. 31 Se aprecia en córnea, con la iluminación focal directa. Se aprecia una opacidad corneal, al parecer, por una cicatrización |
Teniendo en cuenta el tamaño del haz luminoso con el que se observan las estructuras se pueden distinguir tres técnics de iluminación focal directa:
> Paralelepípedo de Vogt.
> Sección óptica.
> Haz cónico.
Paralelepípedo de Vogt
Esta técnica, ocupa un haz luminoso de un ancho entre 2 y 4 mm. En los casos donde la hendidura presenta un ancho mayor que la profundidad aparente de la córnea, la iluminación se denomina correctamente como "Haz ancho" debido a que en ese caso el ancho del haz luminoso es mucho mayor que el grosro de la córnea y la forma geométrica no se corresponde con un paralelepípedo.
En el paralelepípedo, la dispersión de la luz permite observar una porción de la córnea dentro del haz luminoso. De acuerdo a la localización de la luz y el ángulo de iluminación, se pueden diferenciar las capas del tejido corneal, lo que a su vez permite valorar la localización, el ancho y la altura de cualquier objeto o alteración situado en el mismo.
Viendo la Fig. 32 se distinfue la capa lagrimal, que se aprecia por los diferentes destellos luminosos que se desplazan durante el parpadeo, y el epitelio que presenta un aspecto brillante y blanquecino; ambos se encuentran en la cara anterior del paralelepípedo. En la cara lateral de esa estructura se observa una reflexión menos brillante que corresponde a la dispersión producida por el estroma. MIentras que en la cara posterior del paralelepípedo se aprecia el endotelio con un aspecto levemente más brillante.
Para visualizar de forma sencilla la orientación del paralelepípedo, y por ende la ubicación de las diferentes capas de la córnea, se debe tener siempre presente cual es la posición de la fuente de iluminación.
Bibliografía
1. Ophthalmologyweb.com. (2018). The Evolution of Slit Lamp Biomicroscopy. [online] Available at: https://www.ophthalmologyweb.com/Tech-Spotlights/26450-The-Evolution-of-Slit-Lamp-Biomicroscopy/.
2. Nuriatomas.files.wordpress.com. 2022. Biomicroscopio ocular con lámpara de hendidura . [en línea] Disponible en: <https://nuriatomas.files.wordpress.com/2010/04/biomicroscopio-_sist_observacion.pdf>.
3. 1library.co. 2022. SCHAFFER Observan - Evaluación del segmento posterior . [en línea] Disponible en: <https://1library.co/article/schaffer-observan-evaluaci%C3%B3n-del-segmento-posterior.6zk3ww8y>.
4. Revista Española de Patología , 2017. Planos conjugados y sistema de iluminación de Köhler en microscopía óptica. [en línea] (50), p.https://www.sciencedirect.com/science/article/abs/pii/S1699885516300836. Disponible en: <https://doi.org/10.1016/j.patol.2016.11.002>.
5. 2014. Exploración con biomicroscopio ocular: Técnicas y protocolo de intervención . 1ra ed. [ebook] Universidad Nacional de la Plata: Laura E. Brusi, Darío H. Panaroni, Lady V. Argüello Salcedo, Paula A. Faccia, p.ResearchGate. Disponible en: <https://www.researchgate.net/publication/346249088_Exploracion_con_biomicroscopio_ocular_Tecnicas_y_protocolo_de_intervencion>. (Muy agradecido de este libro).
6. Principal, P., médica, E. y párpado, E., 2019. Eversión del párpado: MedlinePlus enciclopedia médica illustración . [en línea] Medlineplus.gov. Disponible en: <https://medlineplus.gov/spanish/ency/esp_imagepages/19662.htm>.
7. Oftalmologiapediatrica. 2018. Conjuntivitis alérgica . [en línea] Disponible en: <https://oftalmologiapediatrica.com.ve/patologias/parpados-y-anexos/conjuntivitis/alergica/>.




excelente blog! espero que sigas publicando, tiene mucha informacion valiosa!
ResponderEliminarsaludos
Gracias, retomaré nuevamente, he estado un poco dejado, pero me pondré las pilas. Saludos
Eliminarmuy bueno pero quisiera mas información
ResponderEliminar